实验六、EDTA标准溶液的配制与标定
实验七、水中钙、镁离子含量的测定
一、实验内容
1、EDTA标准溶液的标定(用CaCO3法)
2、水中钙镁离子总量的测定
二、实验目的
1、掌握EDTA的标定方法
2、了解金属指示剂的使用
3、掌握水中钙、镁离子总量的测定方法
三、实验原理
1、EDTA标准溶液的标定
标定EDTA的物质有:Zn、Pb、Cu、CaCO3、MgSO4·7H2O等,由于不同金属离子与EDTA反应时所用指示剂不同,所处的介质酸度不同,标定出的EDTA浓度有些差异。所以在用EDTA测定某一类金属或金属离子盐浓度时,为减小误差,最好用同类金属或金属离子来标定EDTA。本实验选用CaCO3标定EDTA,选用指示剂为铬黑T,介质条件为氨性缓冲溶液(pH=8.0~10.0)。
![]()
2、水中钙、镁离子总量的测定
水中钙、镁离子总量的大小,反应出水硬度的大小。水的硬度表示方法有:
1)以度表示:10表示1L水中含10mgCaO;
2)以CaCO3含量表示,单位为mg/L,即每L水中含多少克CaCO3。
在pH10.0,此时Ca2+、Mg2+ 都能被EDTA准确滴定
![]()
滴定终点指示剂颜色变化为:酒红色变为纯蓝色
钙镁总量计算:以CaCO3含量表示形式
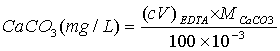
四、实验步骤
1、EDTA标定:
用电子天平准确称取0.25~0.26g干燥后的CaCO3固体于250mL烧杯中,先用少量水湿润,盖上表面皿,缓慢加入10~20mL(1:1)的HCl,(不可太多)加热溶解。溶解后转入250mL容量瓶中,用水稀释至刻度,摇匀。
用移液管取25.00mL上述溶液于250mL锥形瓶中。加入15mLpH10的NH4Cl-NH3缓冲液和2滴铬黑T指示剂,用待标定的EDTA溶液滴定至酒红色变纯蓝色为止,即为终点。记下所消耗的EDTA体积V(mL)。平行滴定2次。
2、水中钙、镁离子总量的测定
用滴定管准确取水样100mL于250mL锥形瓶中,加入50mL蒸馏水,15mL NH4Cl-NH3缓冲溶液和2~3滴铬黑T指示剂,用EDTA溶液滴定至酒红色变纯蓝色时,即为终点。记下所消耗的EDTA体积V‘(mL)。平行滴定2次。
五、数据记录和结果计算
1、CaCO3的称量:m(g)=
Ca2+的浓度:![]()
|
记录项目 |
1 |
2 |
平均 |
|
|
EDTA标定 |
Ca2+体积V(mL) |
25.00 |
25.00 |
|
|
消耗EDTA体积V(mL) |
|
|
|
|
|
EDTA浓度c(mol/L) |
|
|
|
|
|
钙、镁离子总量测定 |
水样的体积V(mL) |
100.00 |
100.00 |
|
|
消耗EDTA体积V‘(mL) |
|
|
|
|
|
CaCO3表示的含量(mg/L) |
|
|
|
|
六、注意事项
1、加热用HCl溶解CaCO3时,要防止溶液溅出。HCl量不要太多。
2、所用指示剂需新配制
3、指示剂用量不可太少(2滴),否则终点颜色变化不敏锐。
4、注意滴定体系的pH范围,应控制在pH10左右,若溶解试样时,加酸太多,则需加入少量氨水中和。加入缓冲溶液以后溶液要混合均匀。
5、取水样的滴定管与装EDTA溶液的滴定管一致。
思考题:
滴定为什么要在缓冲溶液中进行?如果没有缓冲溶液存在,将会导致什么现象发生?